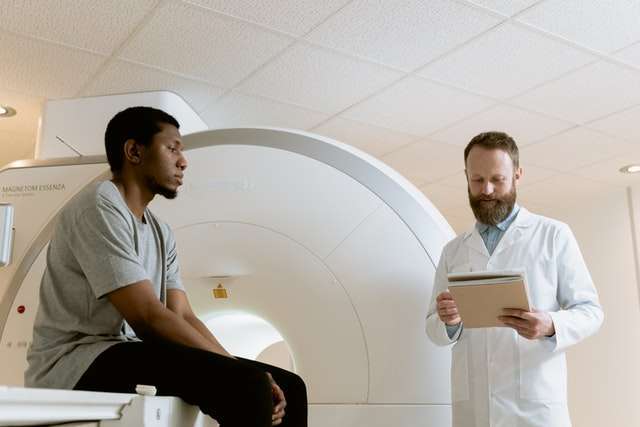
Nesta série de artigos sobre temas da Física das Radiações, vamos conhecer de forma simples e fácil os ensinamentos da Física. O primeiro tema é Radiação, Radioatividade e Teoria Atômica.
Radiação
Radiação é energia que viaja na forma de partículas ou ondas em pacotes de energia chamados fótons. Alguns exemplos de todos os dias são micro-ondas usadas para cozinhar alimentos, ondas de rádio para rádio e televisão, luz, e raios-x usados em medicina.
Radioatividade
Radioatividade é um processo natural e espontâneo, pelo qual os átomos instáveis de um elemento emitem ou irradiam a energia excedente na forma de partículas ou ondas. Estas emissões são coletivamente chamadas de radiações ionizantes. Dependendo de como o núcleo perde este excesso de energia que resultará um átomo energia inferior da mesma forma, ou um núcleo completamente diferente e o átomo podem ser formadas.
Ionização é uma característica particular da radiação produzida quando a decaem de elementos radioativos. Essas radiações são de energia tão alta que, quando eles interagem com materiais, eles podem remover elétrons de átomos no material. Este efeito é a razão de radiação ionizante é perigoso para a saúde e fornece os meios pelos quais a radiação pode ser detectada.